TAS-119是由Taiho創(chuàng)新研發(fā)的腫瘤候選藥���,已經(jīng)在美國和歐洲完成了兩項I期臨床研究��。Vitrac總裁Keizo Koya博士表示�,“我們很榮幸能夠在Taiho出色的工作基礎(chǔ)上進(jìn)一步開發(fā)Aurora A激酶抑抑制劑VIC-1911。Aurora A激酶在腫瘤細(xì)胞的分裂���、存活和增殖等方面起著關(guān)鍵的致癌作用��,我們希望VIC-1911將給癌癥患者提供更多的治療選擇���。”
Aurora激酶于1995年被發(fā)現(xiàn)�,是一種參與細(xì)胞有絲分裂的絲氨酸/蘇氨酸蛋白酶,主要作用于中心粒和紡錘體�,可以維持細(xì)胞分裂的正常進(jìn)行。人類的Aurora激酶共分為A�、B、C三個亞型��,其中Aurora A和Aurora B在人體許多細(xì)胞中表達(dá)��,而Aurora C主要在睪丸組織中表達(dá)�。正常情況下,Aurora A是在有絲分裂的G2/M期發(fā)揮作用��,影響中心粒成熟��,紡錘體形成等過程���。但是在腫瘤細(xì)胞中�,Aurora A在細(xì)胞分裂的整個周期中均有表達(dá)����,影響到胞漿內(nèi)其他蛋白的功能,比如抑制p53��、BRCA1, Chfr等抑癌蛋白的活性��,導(dǎo)致腫瘤細(xì)胞產(chǎn)生���。
Aurora A抑制劑阻斷多條信號通路抑制腫瘤形成[1]
近年來�����,越來越多的研究證明Aurora A抑制劑有望解決諸多臨床上未滿足的需求。比如��,CDK4/6抑制劑可以將腫瘤細(xì)胞的有絲分裂阻滯于G1期從而抑制腫瘤細(xì)胞增殖���,改變了HR+/HER2-乳腺癌患者的治療結(jié)局��。研究人員發(fā)現(xiàn)RB1缺失突變是CDK4/6抑制劑耐藥的一個關(guān)鍵誘因�����,使用Aurora A抑制劑LY3295668 可以針對RB1缺失突變的乳腺癌患者發(fā)揮“合成致死”作用����,解決CDK4/6抑制劑耐藥問題[2]���。另外�����,Aurora A的活化與EGFR TKI治療的獲得性耐藥有關(guān)����,如果解除Aurora A的作用還可以恢復(fù)耐藥腫瘤細(xì)胞對EGFR TKI的敏感性[3]��。因此EGFR TKI作為一線療法與Aurora A抑制劑與聯(lián)用預(yù)期還可以發(fā)揮更大的療效。一項剛發(fā)表不久的I期研究還發(fā)現(xiàn)�����,使用Aurora A抑制劑alisertib治療骨髓纖維化患者的安全性和耐受性良好�����,而且與JAK2抑制劑的作用機(jī)制不同���,Aurora A抑制劑是通過誘導(dǎo)非典型巨核細(xì)胞成熟的新作用機(jī)制給患者帶來減小脾臟體積、減輕骨髓纖維化程度和臨床癥狀的獲益���,有望成為超越ruxolitinib的骨髓纖維化新療法[4]��。
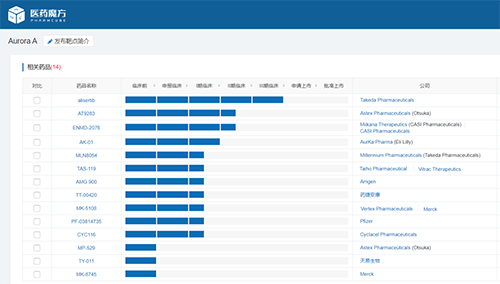 目前全球尚無Aurora A激酶抑制劑獲批上市���,開發(fā)進(jìn)度最快的是武田制藥的alisertib(MLN8237)����,在外周T細(xì)胞淋巴瘤的適應(yīng)癥上處于III期階段。Aurora A抑制劑在近年也贏得了其他制藥巨頭的青睞�����,禮來在2018年5月以1.1億美元首付款和4.65億美元監(jiān)管銷售里程金的方式收購AurKa Pharma公司�,獲得了后者當(dāng)時處于I期階段的Aurora A激酶抑制劑AK01(LY3295668),正在開展針對RB1缺失廣泛期小細(xì)胞肺癌����、接受CDK4/6抑制劑聯(lián)合內(nèi)分泌療法治療后的轉(zhuǎn)移性乳腺癌、復(fù)發(fā)難治成神經(jīng)細(xì)胞瘤的臨床研究�����。目前全球在研Aurora A抑制劑的臨床開發(fā)策略不盡相同�,捷思英達(dá)的VIC-1911具有在差異化的腫瘤適應(yīng)癥實現(xiàn)first in class的潛力。
目前全球尚無Aurora A激酶抑制劑獲批上市���,開發(fā)進(jìn)度最快的是武田制藥的alisertib(MLN8237)����,在外周T細(xì)胞淋巴瘤的適應(yīng)癥上處于III期階段。Aurora A抑制劑在近年也贏得了其他制藥巨頭的青睞�����,禮來在2018年5月以1.1億美元首付款和4.65億美元監(jiān)管銷售里程金的方式收購AurKa Pharma公司�,獲得了后者當(dāng)時處于I期階段的Aurora A激酶抑制劑AK01(LY3295668),正在開展針對RB1缺失廣泛期小細(xì)胞肺癌����、接受CDK4/6抑制劑聯(lián)合內(nèi)分泌療法治療后的轉(zhuǎn)移性乳腺癌、復(fù)發(fā)難治成神經(jīng)細(xì)胞瘤的臨床研究�����。目前全球在研Aurora A抑制劑的臨床開發(fā)策略不盡相同�,捷思英達(dá)的VIC-1911具有在差異化的腫瘤適應(yīng)癥實現(xiàn)first in class的潛力。
捷思英達(dá)位于上海張江科學(xué)城國際醫(yī)學(xué)園區(qū)�,專注于小分子原創(chuàng)抗癌新藥的研發(fā),采用自主研發(fā)和臨床產(chǎn)品引進(jìn)齊頭并進(jìn)的“雙輪驅(qū)動”商業(yè)模式��,加快研發(fā)管線的建立�。Vitrac是捷思英達(dá)在美國波士頓設(shè)立的負(fù)責(zé)項目引進(jìn)和臨床開發(fā)的子公司。捷思英達(dá)的研發(fā)團(tuán)隊及時應(yīng)用國際知名臨床專家最新發(fā)現(xiàn)的藥物作用機(jī)制��,開展國際首創(chuàng)的抗癌新藥研發(fā)���,努力解決國內(nèi)外腫瘤患者高度未滿足的臨床需求��。除了VIC-1911��,捷思英達(dá)產(chǎn)品管線中的ERK激酶抑制劑JSI-1187也具有first in class的潛力��。
推薦閱讀
[1] Anqun Tang , Keyu Gao, Laili Chu, et al. Aurora Kinases: Novel Therapy Targets in Cancers. Oncotarget. 2017 Apr 4;8(14):23937-23954.[2] Xueqian Gong, Jian Du, Stephen H Parsons, et al. Aurora-A kinase inhibition is synthetic lethal with loss of the RB1 tumor suppressor gene. Cancer Discov. 2019 Feb;9(2):248-263.[3]?Khyati?N?Shah ,?Roma Bhatt, Julia?Rotow, et al.?Aurora Kinase A Drives the Evolution of Resistance to Third-Generation EGFR Inhibitors in Lung Cancer. Nat Med. 2019Jan;25(1):111-118.[4] Naseema Gangat , Christian Marinaccio, Ronan Swords, et al.? Aurora Kinase A Inhibition Provides Clinical Benefit, Normalizes Megakaryocytes, and Reduces Bone Marrow Fibrosis in Patients With Myelofibrosis: A Phase I Trial. Clin Cancer Res.? 2019 Aug 15;25(16):4898-4906.