
-?摘要?-
阿爾茨海默?�。ˋD)是最主要的神經(jīng)退行性疾病�,Aβ(特別是Aβ42)是導(dǎo)致AD的重要成因。γ-secretase在Aβ的生成過程中發(fā)揮著重要作用����,因此一直被人們視作抗AD藥物研發(fā)的一個重要靶點。然而���,分子量高達(dá)230kDa����、多次跨膜且高度糖基化的γ-secretase給傳統(tǒng)結(jié)構(gòu)解析方法提出了重大挑戰(zhàn)����。近些年,施一公團(tuán)隊?wèi)?yīng)用Cryo-EM SPA技術(shù)以3.4 ?分辨率解析γ-secretase的結(jié)構(gòu)�,并進(jìn)一步解析了4種靶向藥物與γ-secretase結(jié)合形成復(fù)合物的結(jié)構(gòu),為新一代藥物的發(fā)現(xiàn)和優(yōu)化提供了重要啟示��。
- 01 -
γ-secretase是抗AD藥物研發(fā)的重要靶點
阿爾茨海默?��。?/span>Alzheimer’s Disease, AD)是全球最主要的神經(jīng)退行性疾病����,患病人群的規(guī)模龐大。淀粉樣斑塊沉積是AD的兩大病理特征之一���,這些斑塊主要由β-淀粉樣小肽(β-amyloid, Aβ)沉積形成��。自1991年發(fā)現(xiàn)淀粉樣前體蛋白(Amyloid Precursor Protein, APP)突變參與家族性AD(FAD)發(fā)病以來�,淀粉樣蛋白級聯(lián)假說就逐漸成為AD發(fā)病機理的主流理論�,而早老素1(Presenilin 1, PS1)突變體的發(fā)現(xiàn)進(jìn)一步支持了這一假說[1]。
Aβ是APP經(jīng)由淀粉樣生成途徑被分泌酶切割產(chǎn)生的片段�����。在該途徑中��,APP的N端在質(zhì)膜的胞外側(cè)首先被β-分泌酶(β-secretase)切割�����,然后其C端的99個氨基酸殘基(C99)會進(jìn)一步被γ-分泌酶(γ-secretase)切割����,產(chǎn)生胞內(nèi)域和一個包含48或49個殘基的跨膜區(qū)短肽(Aβ48或Aβ49)�。Aβ48和Aβ49可繼續(xù)被γ-secretase以消化3或4個殘基的方式切割。其中Aβ49被切割后產(chǎn)生Aβ46,Aβ43和Aβ40���。而Aβ48被切割后產(chǎn)生Aβ45,Aβ42和Aβ38[2]���。人體中Aβ存在的最主要形式是Aβ40和Aβ42�。由于這些Aβ片段幾乎包含了APP這一單次跨膜蛋白的整個跨膜區(qū)段而具有很強的疏水性���,所以極易聚集并在體內(nèi)形成淀粉樣纖維��,進(jìn)而沉積形成淀粉樣斑塊���。其中,Aβ42和Aβ43最容易聚集并產(chǎn)生神經(jīng)毒性���,從而引起AD[3]�����。
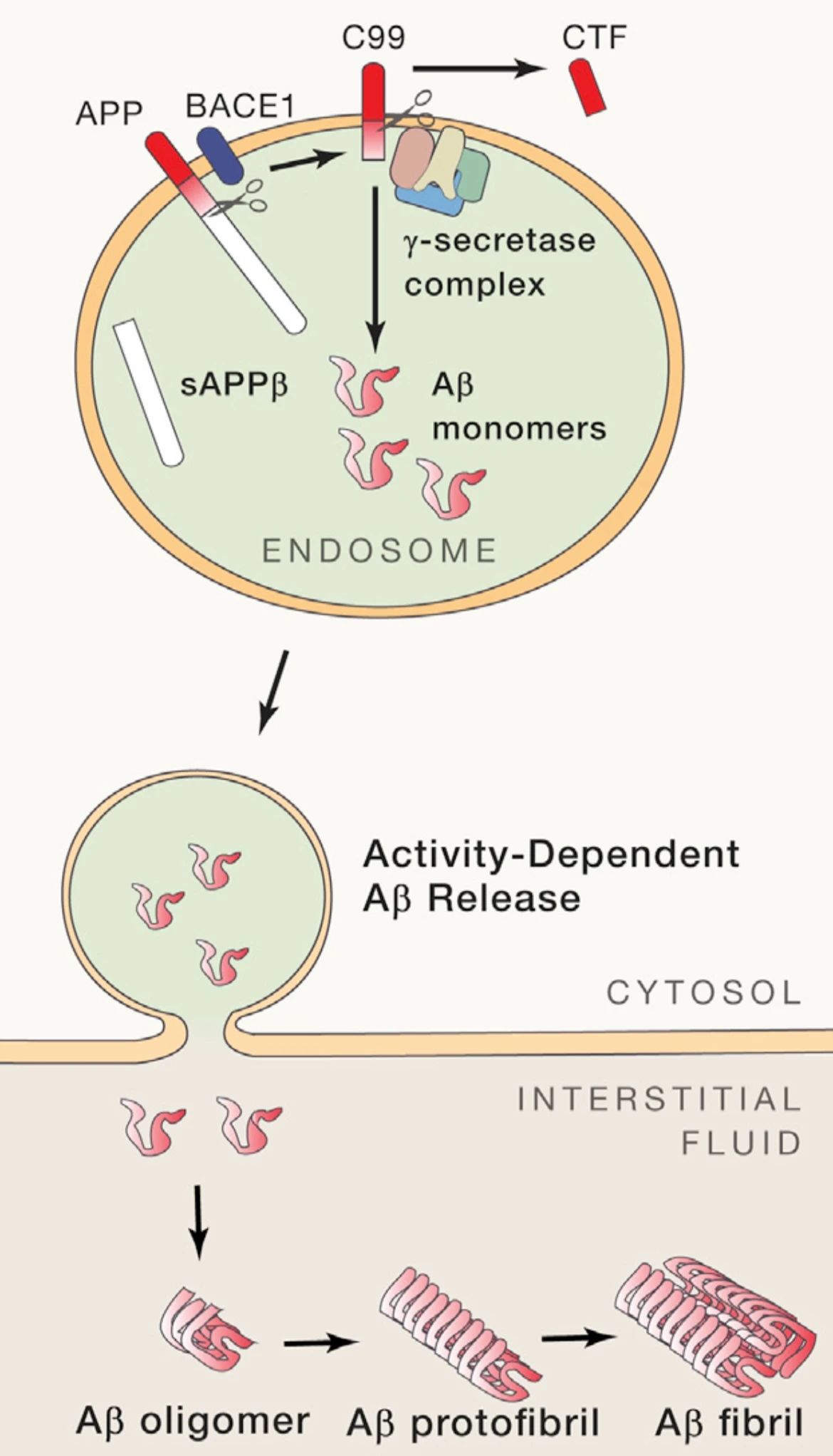
圖1. Aβ單體主要在神經(jīng)元內(nèi)體中產(chǎn)生并外排至細(xì)胞間質(zhì)中逐步聚集(Justin M. Long and David M. Holtzman1, 2019)
人源γ-secretase由Presenilin, Aph-1, Pen-2和Nicastrin共4個亞基組成�,其中Presenilin構(gòu)成了執(zhí)行酶活性的功能亞基����,它具有PS1和PS2兩個同源異構(gòu)體�����。目前在PS1, PS2和APP上鑒定出200多個突變與AD相關(guān)�����,絕大部分都集中在PS1上[4]����。這些突變中的大部分突變導(dǎo)致APP不正常切割��,致使生成Aβ變多或者Aβ42/Aβ40的比率升高[5]�。這些發(fā)現(xiàn)表明Aβ(特別是Aβ42)是導(dǎo)致AD的重要成因。在這個假設(shè)前提下���,如能夠抑制或者調(diào)節(jié)γ-secretase的切割活性,或許能夠減少Aβ的產(chǎn)生�����,達(dá)到治療AD的目的[6]�����。因此理解γ-secretase的分子機理以及藥物對γ-secretase的作用機制極為關(guān)鍵。
- 02 -
冷凍電鏡單顆粒分析技術(shù)解決γ-secretase結(jié)構(gòu)解析重大難題同其他多次跨膜膜蛋白一樣��,科學(xué)家們在很長時間內(nèi)都無法得到生長良好的γ-secretase蛋白晶體���,因此很難通過X-Ray衍射這一傳統(tǒng)技術(shù)獲得γ-secretase的高分辨率結(jié)構(gòu)���。同時,面對分子質(zhì)量高達(dá)230kDa���,具4個亞基且高度糖基化的成熟γ-secretase��,NMR分析也同樣力不從心��。2013年程亦凡教授與David Julius博士合作����,率先應(yīng)用冷凍電鏡單顆粒分析技術(shù)(Cryo-EM Single Particle Analysis, Cryo-EM SPA)解析了TRPV1蛋白結(jié)構(gòu)[7]���,并將其分辨率提升到近原子級別的3.4 ?����,為Cryo-EM在結(jié)構(gòu)領(lǐng)域的應(yīng)用帶來了重大突破。同時也讓人們意識到����,Cryo-EM很可能成為解決高分子量多次跨膜蛋白結(jié)構(gòu)解析難題的新一代技術(shù)。
2015年����,施一公團(tuán)隊率先在Nature上發(fā)表文章,報告了應(yīng)用Cryo-EM SPA技術(shù)解析的γ-secretase近原子級蛋白結(jié)構(gòu)���,分辨率達(dá)到?3.4 ?[8]�����。在2018-2019年��,施一公團(tuán)隊又先后在Nature和Science上發(fā)表文章����,利用冷凍電鏡解析了人源γ-secretase識別并結(jié)合Notch和APP的結(jié)構(gòu)基礎(chǔ)���,關(guān)鍵區(qū)域分辨率分別達(dá)到2.7 ?和2.6 ?[9,10]。
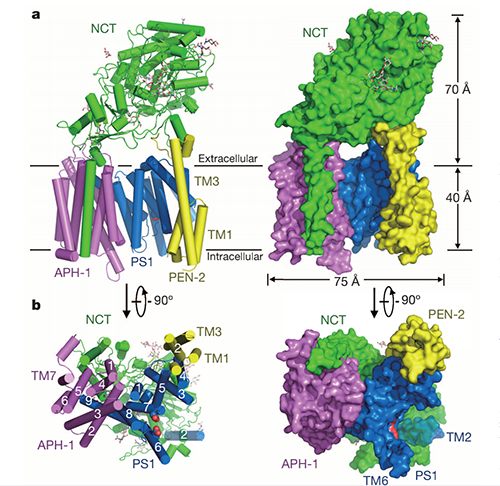
圖2.?人源γ-secretase近原子級結(jié)構(gòu)?(Bai.X.-C., et al. 2015)
- 03?-
冷凍電鏡高效解析候選藥物與γ-secretase復(fù)合物結(jié)構(gòu)�,領(lǐng)航新一代藥物研發(fā)
γ-分泌酶抑制劑(GSI)和調(diào)節(jié)劑(GSM)的開發(fā)為AD提供了富有前景的治療機會�。但這些GSI和GSM如何靶向γ-secretase仍然未知����。2021年施一公團(tuán)隊在Cell上發(fā)表新文章,再次應(yīng)用Cryo-EM SPA解析了4種候選分子與γ-secretase復(fù)合物結(jié)構(gòu)[11]����。文章報告γ-secretase分別與3種GSI(Semagacestat, Avagacestat和過渡狀態(tài)類似物L458)或1種GSM(E2012)結(jié)合復(fù)合物結(jié)構(gòu),分辨率2.6–3.1?�����,均達(dá)到近原子級別���。值得注意的是�����,每個GSI在PS1上均占據(jù)底物位置�,從而干擾底物的募集��。而E2012可與γ-secretase別構(gòu)位點結(jié)合�,這可能解釋了其調(diào)節(jié)活性。這些基于冷凍電鏡的結(jié)構(gòu)解析工作�,有望指導(dǎo)基于藥物構(gòu)效關(guān)系(Structure Activity Relationship, SAR)的下一代靶向γ-secretase藥物的開發(fā)����。
本研究首先在體外驗證了課題組純化的重組γ-secretase的活性����,并使用Alpha Lisa Assay測量不同條件重組γ-secretase切割C99生成Aβ40的活性,用于評估3種GSI靶向Aβ生成的抑制作用�����。之后解析γ-secretase分別結(jié)合Semagacestat, Avagacestat���,L458和E2012后形成的復(fù)合物電鏡結(jié)構(gòu)�。Semagacestat由Eli Lily開發(fā)��,是第一個進(jìn)入III期臨床評估的GSI[12]���。與令人鼓舞的早期結(jié)果相反[13]���,Semagacestat未顯示預(yù)期的認(rèn)知改善,卻產(chǎn)生嚴(yán)重副作用[14]��,這歸因于Semagacestat抑制了γ-secretase對Notch等其他重要底物的水解[15]。
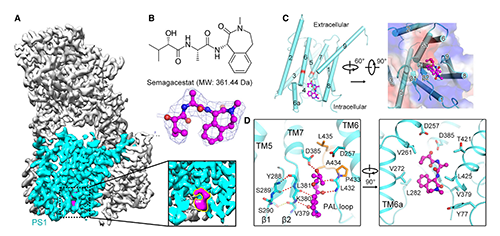
圖3.?人源γ-secretase結(jié)合Semagacestat的結(jié)構(gòu)基礎(chǔ)?(原文圖2)
結(jié)構(gòu)解析結(jié)果顯示:Semagacestat的結(jié)合位點與APP-C99或Notch-100的β-鏈完全相同�����,位于PS1胞內(nèi)側(cè)的深腔中(圖3, A)��。該發(fā)現(xiàn)為Semagacestat抑制γ-secretase的活性提供了直接且令人滿意的解釋�����。Semagacestat占據(jù)該位點可能阻礙PS1和底物間雜化β-片層形成����,從而抑制γ-secretase水解底物���。Semagacestat與PS1的K380和L432的主鏈形成4個氫鍵(圖3, D左)��,這兩個殘基在γ-secretase識別C99或Notch -100時同樣發(fā)揮重要作用[9,10]����,提示Semagacestat與PS1結(jié)合模式與PS1的天然底物相似���。此外�,Semagacestat上芳香環(huán)和甲基還與PS1疏水殘基的側(cè)鏈接觸并形成生范德華力,但仍然留下了幾個小縫隙(圖3)��。若在這些縫隙中填充其他疏水基團(tuán)��,以填充Semagacestat與V261或V272周圍的疏水空間����,可能提高新一代抑制分子的特異性和抑制能力。
為了解決Semagacestat底物選擇性差��、毒副作用顯著的問題�����,Avagacestat作為具有底物選擇性的GSI而被開發(fā)���。相比于Semagacestat��,Avagacestat選擇性抑制PS1對C99的水解�����,作用比底物為Notch時強約3-193倍[16]���。盡管如此�,高劑量的Avagacestat仍然會抑制PS1對Notch的水解并顯示毒性����。Avagacestat的結(jié)合模式如何賦予其底物選擇性是個非常有價值的研究問題。復(fù)合物的結(jié)構(gòu)顯示����,雖然Avagacestat與Semagacestat的化學(xué)性質(zhì)完全不同��,但Avagacestat與Semagacestat結(jié)合位點完全相同(圖4, B)���。因此Avagacestat同樣占據(jù)PS1底物結(jié)合位點����,阻止雜化β-片層的形成從而抑制γ-secretase的活性�����。
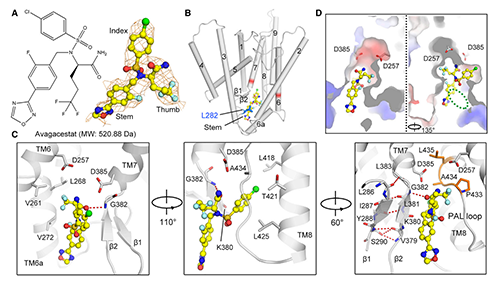
圖4.?人源γ-secretase結(jié)合Avagacestat的結(jié)構(gòu)基礎(chǔ)?(原文圖3)
但Avagacestat的具體結(jié)合模式與Semagacestat存在很大的區(qū)別�����,這可能是其抑制作用底物選擇性的原因����。Avagacestat主要與PS1疏水殘基互作�����,只與G382主鏈酰胺基形成1個氫鍵(圖4, C)�。Avagacestat三氟戊酰胺基(圖4, A中Thumb區(qū))位于PS1 N端(NTF)V261�����,L268和V272構(gòu)成的疏水口袋(圖4, C左)���。Avagacestat氯苯基(圖4, A中Index區(qū))結(jié)合在PS1 C端(CTF)與L418�����,T421����,L425和A434間形成范德華力(圖4, C右)��。Avagacestat惡二唑氟芐基(圖4, A中Stem區(qū))一側(cè)與PS1結(jié)合(圖3D���,左)�����,另一側(cè)在空間上相對裸露�����,因此可用于進(jìn)一步修飾(圖3D����,右中綠色圈),以增強抑制強度和特異性����。
與Semagacestat和Avagacestat不同�,L458是一種競爭性過渡態(tài)類似物抑制劑(TSA)。L458直接結(jié)合PS1活性位點�,在空間上大致與Semagacestat和Avagacestat相同(圖5, B)。?L458和位于催化中心的2個天冬氨酸(D257, D385)同時形成氫鍵����,并與與PS1上的其他氨基酸形成另外的5個氫鍵(圖5, C),還能同周圍的疏水殘基形成范德華力(圖5, D)�。相較于非TSA抑制劑,L458可以與PS1催化位點上方的口袋進(jìn)一步結(jié)合���,以加固抑制劑與催化殘基D257和D385之間的氫鍵����。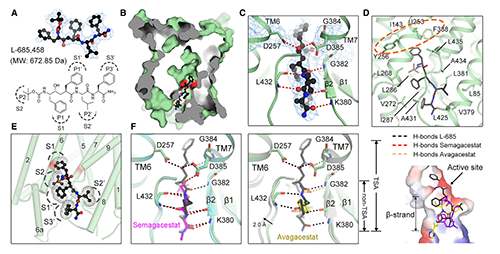
圖5.?人源γ-secretase結(jié)合L458的結(jié)構(gòu)基礎(chǔ)?(原文圖5)除GSI以外,GSM也被公認(rèn)為是一類有吸引力的小分子����。GSM很可能會促進(jìn)Aβ42的進(jìn)一步切割,從而減少易于聚集的Aβ的產(chǎn)量[17]����。與GSI不同,GSM在遠(yuǎn)離活性位點的別構(gòu)位點處識別并結(jié)合γ-secretase�����。這提示我們�,特定GSI可與GSM配合使用并發(fā)揮協(xié)同作用,進(jìn)而實現(xiàn)底物選擇性抑制��。2013年�����,Pozdnyakov等曾報道L458可以增強E2012與γ-secretase的結(jié)合力[17]����。
體外孵育實驗表明��,單獨使用5 nM的?L458或50 mM GSM E2012時僅導(dǎo)致γ-secretase水解C99活性的溫和抑制����,而二者聯(lián)用卻能幾乎完全抑制水解(圖6, A)����。為闡釋L458與E2012對γ-secretase活性調(diào)節(jié)的協(xié)同作用,團(tuán)隊以2.6?的分辨率獲得了同時與E2012和L458結(jié)合的重組人源γ-secretase的冷凍電鏡結(jié)構(gòu)����。E2012插入PS1和NCT界面處的疏水口袋中,并與PS1的loop-1互作(圖6, C)���,覆蓋部分底物結(jié)合通道(圖6, D),從而調(diào)節(jié)γ-secretase對不同底物的活性�。將結(jié)合E2012的γ-secretase與APP片段復(fù)合起來,發(fā)現(xiàn)E2012與C99的N端發(fā)生沖突(圖6, F&G)�,這種沖突可能使C99募集更困難或促進(jìn)C99的解旋退繞。后者可導(dǎo)致C99進(jìn)一步向下移動到PS1活性位點��,并增加將Aβ切割成較短片段的可能性�。先前的研究也已證明:存在E2012時Aβ40和Aβ42產(chǎn)量降低��,而Aβ38產(chǎn)量升高[17]�。
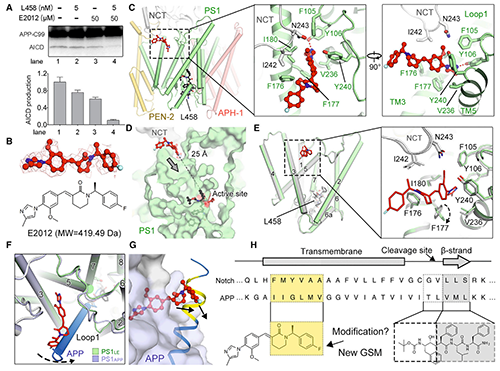
圖6.?人源γ-secretase結(jié)合E2012的結(jié)構(gòu)基礎(chǔ)?(原文圖5)
- 總結(jié) -
時至今日��,科學(xué)家們?yōu)榱斯タ薃D已經(jīng)積累了幾十年的努力��。然而我們尚未發(fā)現(xiàn)任何一種手段可以有效緩解疾病����,甚至連延緩認(rèn)知障礙的進(jìn)展都很難做到。這在很大的程度上和AD病因不完全明確����、相關(guān)生物大分子的結(jié)構(gòu)和功能尚未被完全闡明有關(guān)。施一公團(tuán)隊這項工作應(yīng)用Cryo-EM SPA技術(shù)����,在近原子分辨率上解析了γ-secretase與多種小分子結(jié)合后形成復(fù)合物的結(jié)構(gòu)。有關(guān)結(jié)果一方面進(jìn)一步揭示了現(xiàn)有先導(dǎo)化合物或第一代藥物分子的作用機制��,另外一方面也可以啟發(fā)研發(fā)人員基于結(jié)構(gòu)對藥物分子進(jìn)行優(yōu)化設(shè)計�����。隨著技術(shù)的不斷進(jìn)步��,Cryo-EM SPA技術(shù)的解析分辨率已經(jīng)可以達(dá)到3?以下,有關(guān)文章在近年也呈現(xiàn)爆發(fā)式增長���。今后�����,冷凍電鏡必將成為藥物發(fā)現(xiàn)和優(yōu)化的強大助力���,為守護(hù)人類健康做出更大貢獻(xiàn)。
- Sherington R., et al. Cloning of the gene bearing missense mutations in early onset familial Alzheimer disease.? (1995)
- Takami M., et al. Gamma-Secretase: successive tripeptide and tetrapeptide release from the transmembrane domain of beta-carboxyl terminal fragment. ?(2009)
- Kidd M. Alzheimer’s Disease–an Electron Microscopical Study. (1946)
- Rogaev E.I., et al. Familial Alzheimer’s disease in kindreds with missense mutations in a gene on chromosome 1 related to the AD type 3 gene. (1995)
- Borchelt D.R., et al. Familial Alzheimer’s disease-linked presenilin 1 variants elevate Abeta1-42/1-40 ratio in vitro and in vivo. (1996)
- Golde T.E., et al. Targeting Aβ and tau in AD, an early interim report. (2010)
- Liao M., et al. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. (2013)
- An atomic structure of human γ-secretase. (2015)
- YangG., et al. Structural basis of Notch recognition by γ-secretase. (2018)
- ZhouR., et al. Recognition of the APP by human γ-secretase. (2019)
- YangG., et al. Structural basis of γ-secretase inhibition and modulation by small molecule drugs. (2021)
- Henley, D.B., et al. Development of Semagacestat (LY450139), a functional gamma-secretase inhibitor, for the treatment of Alzheimer’s disease. (2009)
- Siemers, E.R., et al. Safety, tolerability, and effects on plasma and erebrospinal fluid amyloid-beta after inhibition of gamma-secretase. (2007)
- Doody, R.S., et al. A phase 3 trial of semagacestat for treatment of AD. (2013)
- Doody, R.S., et al. Alzheimer’s Disease Cooperative Study (2015).
- Cha′ vez-Gutie′rrez, L., et al. The mechanism of γ-secretase dysfunction in familial Alz[1]heimer disease.?(2012)
- Pozdnyakov, N., et al. γ-secretase modulator (GSM) photoaffinity probes reveal distinct allosteric binding sites on presenilin.?(2013)
水木未來(北京)科技有限公司是一家結(jié)構(gòu)和計算驅(qū)動的新型藥物研發(fā)公司����,擁有亞太區(qū)第一個商業(yè)化冷凍電鏡服務(wù)平臺,基于冷凍電鏡�、計算化學(xué)、機器學(xué)習(xí)和高性能計算核心技術(shù)�����,在小分子�、抗體藥��、蛋白降解�、基因治療等領(lǐng)域推動數(shù)字化創(chuàng)新�,助力全球創(chuàng)新藥企大幅提升藥物研發(fā)效率和成功率��。水木未來2017年創(chuàng)立于清華大學(xué)���,核心團(tuán)隊由優(yōu)秀的生命和計算科學(xué)家�����、IT互聯(lián)網(wǎng)和醫(yī)藥產(chǎn)業(yè)專家組成�,成立伊始����,已成功為來自中國、美國���、歐洲的30余家創(chuàng)新藥企和頂級科研機構(gòu)提供了結(jié)構(gòu)生物學(xué)和藥物發(fā)現(xiàn)服務(wù)��。