2022月7月���,蘇州百邁生物醫(yī)藥有限公司(以下簡稱百邁)收到國家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)正式簽發(fā)的藥物臨床試驗(yàn)批準(zhǔn)通知書,認(rèn)定百邁作為藥品上市許可持有人自主研發(fā)的BM201注射液(受理號(hào):CXHL2200273)符合藥品注冊(cè)的有關(guān)要求���,允許進(jìn)入臨床試驗(yàn)。
BM201注射液是一款用于治療成人晚期實(shí)體瘤的長效緩釋免疫激動(dòng)劑����,在臨床上將與放射治療聯(lián)合,針對(duì)晚期實(shí)體瘤患者的耐受性�、藥代動(dòng)力學(xué)和初步療效開展研究。
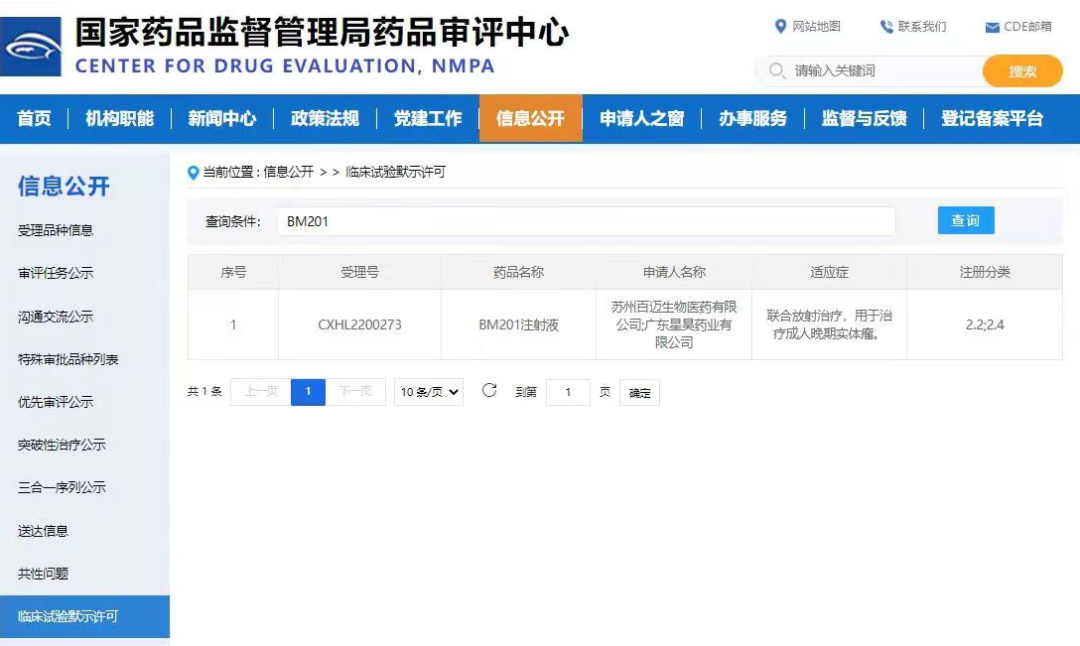
國家藥監(jiān)局官網(wǎng):蘇州百邁BM201注射液獲臨床默示許可
BM201注射液的IND獲批是百邁在新藥開發(fā)道路上的重要里程碑����,也是公司在腫瘤免疫治療戰(zhàn)略方向的重要突破之一,對(duì)于公司后續(xù)發(fā)展和商業(yè)布局具有重要意義����。
BM201
BM201作為一種免疫激動(dòng)劑療法的藥物,在設(shè)計(jì)時(shí)考慮到從避免全身系統(tǒng)暴露的角度出發(fā)���,通過局部瘤內(nèi)注射的方式將炎癥局限在腫瘤局部�,同時(shí)配合放射治療激活全身的腫瘤特異性免疫反應(yīng)����。
另外����,BM201從延長給藥周期的角度出發(fā)��,設(shè)計(jì)為自緩釋劑型����,臨床前研究表面其在瘤內(nèi)單次給藥后半衰期可超過一周,能夠避免頻繁的瘤內(nèi)給藥��,提高患者依從性的同時(shí)實(shí)現(xiàn)了長效且持續(xù)的免疫激活��。
BM201未來將在臨床上與大分割放療聯(lián)合使用�����,增強(qiáng)放射治療誘導(dǎo)的腫瘤特異性免疫反應(yīng)��,以期使腫瘤患者獲得更好的療效��。
臨床意義
在免疫治療時(shí)代��,放射治療已不僅僅是一種局部治療手段,更是成為了理想免疫治療的一個(gè)組成部分�����。局部輻射特別是大分割放療會(huì)引發(fā)腫瘤細(xì)胞的免疫原性死亡����,造成腫瘤抗原的暴露,產(chǎn)生一定概率的放療遠(yuǎn)隔效應(yīng)�����。但是����,單獨(dú)放療的遠(yuǎn)隔效應(yīng)在臨床發(fā)生的概率并不高�,其原因是放療暴露的抗原在免疫抑制的腫瘤微環(huán)境中往往不能被抗原呈遞細(xì)胞有效攝取。
BM201是一種長效緩釋的免疫激動(dòng)劑��,可以持續(xù)激活抗原呈遞細(xì)胞����,后者則可以將放療暴露的腫瘤抗原呈遞給T細(xì)胞,從而顯著增強(qiáng)放療誘導(dǎo)的腫瘤特異性免疫反應(yīng)�,實(shí)現(xiàn)放射治療原位治療增敏的同時(shí)提高遠(yuǎn)隔效應(yīng)的概率,未來如進(jìn)一步聯(lián)合PD1類免疫療法則有望實(shí)現(xiàn)全身性的腫瘤抑制。因此�,放射治療在與BM201的配合下,可獲得持續(xù)性的免疫激活�,實(shí)現(xiàn)1+1>2的療效。
關(guān)于百邁生物醫(yī)藥
InnoBM Pharmaceuticals
蘇州百邁生物醫(yī)藥有限公司成立于2019年���,創(chuàng)始人為蘇州大學(xué)劉莊教授���。公司基于創(chuàng)始人在生物材料領(lǐng)域十余年的交叉學(xué)科基礎(chǔ)研究積累,聚焦于創(chuàng)新腫瘤免疫治療藥物的研發(fā)與轉(zhuǎn)化�,致力于面向臨床需求做有價(jià)值的突破性創(chuàng)新。
百邁立足于堅(jiān)實(shí)的科學(xué)邏輯�,從創(chuàng)新生物材料的技術(shù)策略出發(fā),獨(dú)辟蹊徑地繞開基于特點(diǎn)靶點(diǎn)的同質(zhì)化研究���,通過腫瘤微環(huán)境調(diào)控和藥物緩控釋設(shè)計(jì)�����,協(xié)同激活腫瘤特異性免疫反應(yīng)���,“逐一破解”免疫治療中的各類瓶頸問題,以期實(shí)現(xiàn)腫瘤免疫治療臨床應(yīng)答率的提升����,相關(guān)多個(gè)管線預(yù)期將具有廣闊的市場前景���。