近日���,由智康弘義研發(fā)的WEE1小分子抑制劑SC0191片通過國家藥品監(jiān)督管理局(NMPA)的臨床試驗默示許可�����,擬用于與吉西他濱或紫杉醇等化療藥物聯(lián)合治療晚期卵巢癌�,這是SC0191項目通過的第三項臨床默示許可�,公司將于近期啟動本項 Ib/II 期臨床研究。
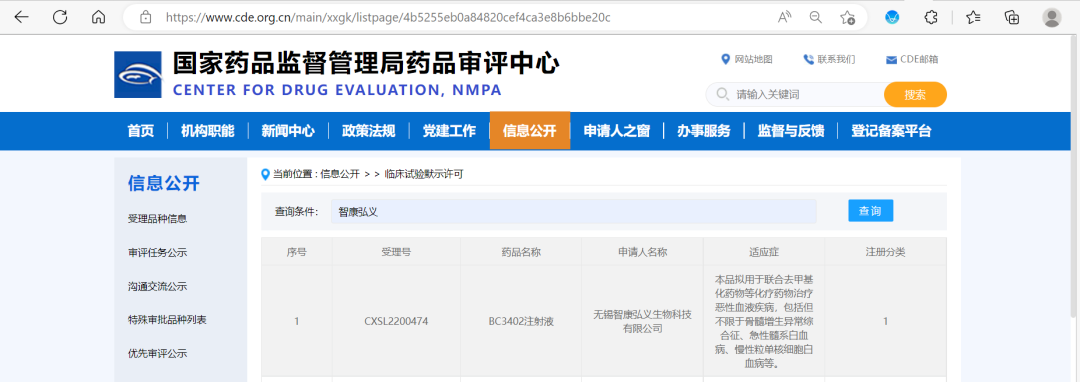
來源:國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)
WEE1是DNA損傷修復通路中重要的調(diào)控激酶�,是繼PARP抑制劑在臨床獲得成功后���,DNA損傷修復通路中的又一熱門靶點�����,具有開發(fā)成為新一代靶向療法的潛力��。除單藥治療外�����,WEE1抑制劑還具有與放化療���、ATR抑制劑1��、免疫治療藥物等聯(lián)合用于多種腫瘤治療的潛質(zhì)�,具有廣闊的臨床應用場景����。
SC0191是公司在DNA損傷修復通路中重點開發(fā)的一款分子,是國內(nèi)首個獲批進入臨床�、在全球具有臨床進度領先優(yōu)勢的高度差異化的WEE1小分子抑制劑。臨床前研究表明SC0191具有良好的安全性����,同時在多種動物模型中展現(xiàn)出良好的單藥和聯(lián)合用藥抗腫瘤活性,尤其在已進行的針對晚期實體瘤開展的 I 期臨床研究中已觀察到明顯的初步有效性信號���,有望成為潛在的“Best-in-Class”藥物。
基于產(chǎn)品已獲得的臨床證據(jù)和進度優(yōu)勢��,公司憑借領先的轉化醫(yī)學和臨床開發(fā)系統(tǒng)能力,致力于推動該款產(chǎn)品快速上市�,公司也將充分挖據(jù)項目潛力,開展不同適應癥的臨床探索���,及早惠及更多患者����。
參考1:
ATR是DNA損傷修復通路中的另一重要調(diào)控激酶�,ATR抑制劑在臨床中與WEE1抑制劑具有潛在的協(xié)同作用。
SC0245是公司在DNA損傷修復通路中另一款重點開發(fā)的分子�,是國內(nèi)首個獲批臨床的ATR小分子抑制劑,在已進行的 I 期臨床研究中已觀察到初步有效性信號�,同時SC0245聯(lián)合拓撲異構酶Ⅰ抑制劑(伊立替康或拓撲替康)治療小細胞肺癌的?Ib/II?期臨床研究已于今年獲得NMPA的臨床試驗默示許可,目前正處于臨床啟動階段�����。
關于智康弘義
“做好藥����,為生命更美好/Better Medicine for Better Life”,是智康弘義的崇高使命�。
智康弘義成立于2017年12月,公司以患者和疾病為中心,高度重視疾病生物學在新藥研制中的基礎性作用��,以滿足未來重大未滿足的臨床需求和新場景為導向����,積極推動領先的轉化醫(yī)學和臨床研究業(yè)務平臺化發(fā)展,現(xiàn)階段優(yōu)先專注于腫瘤�、腎病等疾病“First-in-Class/Best-in-Class”創(chuàng)新藥物的研發(fā)、臨床試驗和商業(yè)化�。
自公司成立以來,在化學小分子���、單克隆抗體��、雙特異性抗體�、抗體偶聯(lián)藥物(ADC)等不同技術領域均進行了管線布局����,憑借高效的研發(fā)和運營模式,目前已有5款新藥順利開展臨床 I 期��、1款正在進入臨床 II 期��,PI均由領域內(nèi)頂級專家擔任��,臨床試驗的質(zhì)量和進度延續(xù)了產(chǎn)品臨床前研發(fā)的優(yōu)勢,大部分產(chǎn)品在國際上取得了臨床進度上的領先���。公司另有多款ADC和雙抗新藥產(chǎn)品處于臨床前開發(fā)及 Pre-IND 階段。
智康弘義已組建了一支由藥物科學�����、臨床醫(yī)學��、轉化醫(yī)學等交叉領域科學家組成的科研管理團隊領導各環(huán)節(jié)研發(fā)業(yè)務����,同時配備了深耕本土、熟悉中國環(huán)境的運營團隊�����,系統(tǒng)性地保證了公司全流程研發(fā)質(zhì)量和效率�。公司將進一步增強新技術領域及全球商業(yè)化的力量配置,以鞏固公司領先的綜合研發(fā)實力�����,積極布局和拓展海外市場���。
智康弘義正以“快速成長為中國領先���,擁有持續(xù)創(chuàng)新能力�、核心組合產(chǎn)品����、多樣化創(chuàng)新療法,及深度商業(yè)化能力的生物醫(yī)藥公司”為目標����,致力于更好、更多地造福全球患者�,為中國生物醫(yī)藥產(chǎn)業(yè)的新一輪發(fā)展貢獻力量。