對(duì)于亞盛而言��,多個(gè)產(chǎn)品處于臨床階段��,并且均看到一定積極的療效和安全性信號(hào)��,顯然推動(dòng)臨床進(jìn)展是其現(xiàn)階段首要任務(wù)���。
撰文 | 程昊紅
亞盛醫(yī)藥日前宣布公司重要在研產(chǎn)品APG-2575再下一城���,其在中國(guó)又獲批一項(xiàng)Ib/II期臨床試驗(yàn)批件。在此之前的一個(gè)月內(nèi)���,APG-2575已接連獲得中美三項(xiàng)臨床試驗(yàn)許可�����,呈逆勢(shì)加速態(tài)勢(shì)��。而在一周前�,亞盛醫(yī)藥發(fā)布2019年公司年報(bào),在其年報(bào)中有個(gè)數(shù)據(jù)非常亮眼:公司有8個(gè)1類新藥在臨床階段�,在中國(guó)、美國(guó)����、澳大利亞三地正在開展的I/II期臨床研究數(shù)量已超過(guò)30個(gè),意味著全球開發(fā)全面推進(jìn)����。
?
而去年10月�����,亞盛實(shí)現(xiàn)了香港上市�����,并在上市之后不久,正式宣布在蘇州奠基公司全球總部����、研發(fā)中心及產(chǎn)業(yè)基地。高速推動(dòng)的臨床研發(fā)進(jìn)度�����、一系列引人矚目的動(dòng)作�����,預(yù)示著亞盛進(jìn)入全新的發(fā)展階段�。
?
事實(shí)上,亞盛專注的細(xì)胞凋亡領(lǐng)域�����,目前只有艾伯維/基因泰克開發(fā)的Bcl-2抑制劑Venetoclax于2016年獲批上市�����,可謂20年磨一劍���。Venetoclax在2019年銷售額超過(guò)10億美元��,未來(lái)預(yù)計(jì)峰值年銷售可達(dá)60億美元���。擁有可觀市場(chǎng)前景的研究領(lǐng)域����,卻因?yàn)檠邪l(fā)難度�,多年來(lái)讓業(yè)界望而卻步。
?
為通關(guān)這一藥物開發(fā)高難領(lǐng)域��,亞盛啟動(dòng)了覆蓋較為完整的產(chǎn)品線布局��,并逐步加速這些全新機(jī)制產(chǎn)品的臨床進(jìn)度����。同時(shí)憑借對(duì)下一代激酶抑制劑的多元化布局,公司亦有望兩年內(nèi)迎來(lái)首個(gè)商業(yè)化產(chǎn)品�����。
?
拓展閱讀:一種堅(jiān)守:Bcl-2抑制劑開發(fā)沉浮30年
?
細(xì)胞凋亡通路全面布局
?
細(xì)胞凋亡領(lǐng)域從機(jī)理發(fā)現(xiàn)到第一個(gè)產(chǎn)品上市歷時(shí)30余年����,Venetoclax開發(fā)者艾伯維為推動(dòng)產(chǎn)品開發(fā)還發(fā)明了藥物設(shè)計(jì)的全新方法學(xué)——以片段為基礎(chǔ)的藥物設(shè)計(jì)(FBDD)����,細(xì)胞凋亡尤其是Bcl-2靶點(diǎn)領(lǐng)域藥物開發(fā)的艱難可見一斑��。
?
在亞盛共同創(chuàng)始人����、董事長(zhǎng)兼CEO楊大俊看來(lái)���,細(xì)胞凋亡藥物開發(fā)有3方面挑戰(zhàn):一�����、從細(xì)胞凋亡通路藥物設(shè)計(jì)來(lái)講���,蛋白-蛋白相互作用是非常高難的靶點(diǎn);第二����、Bcl-2的結(jié)合口袋較大,很難設(shè)計(jì)出小分子阻斷整個(gè)結(jié)合口袋����;第三,Bcl-2靶點(diǎn)在線粒體膜上��,存在藥物輸送問(wèn)題,進(jìn)一步增加了成藥難度�。
?
以Bcl-2家族蛋白為靶點(diǎn)的藥物研發(fā)多年來(lái)被證實(shí)極其困難,但2016年4月在美國(guó)成功上市的Bcl-2選擇性抑制劑Venclexta為該靶點(diǎn)藥物的開發(fā)提供了強(qiáng)有力的臨床驗(yàn)證依據(jù)����。
?
亞盛核心團(tuán)隊(duì)在細(xì)胞凋亡領(lǐng)域堅(jiān)持研發(fā)20多年,目前公司在該領(lǐng)域的布局非常全面����,其系列產(chǎn)品線上共有5個(gè)產(chǎn)品,分別為Bcl-2選擇性抑制劑APG-2575�、Bcl-2/Bcl-xL抑制劑APG-1252、IAP抑制劑APG-1387�����、MDM2-p53抑制劑APG-115和泛Bcl-2抑制劑AT-101���。目前這些在研產(chǎn)品均向臨床Ⅰb/Ⅱ期或者Ⅱ期推動(dòng)中�����。
?
Bcl-2選擇性抑制劑APG-2575是在全球?qū)用胬^Venclexta之后罕有的進(jìn)入臨床開發(fā)階段的Bcl-2選擇性抑制劑�����,可謂直接對(duì)標(biāo)Venclexta����。亞盛開展的早期研究發(fā)現(xiàn)��,APG-2575的半衰期比較短���,在臨床設(shè)計(jì)上采用每天劑量遞增�。由于Bcl-2靶點(diǎn)的特性��,誘導(dǎo)癌細(xì)胞凋亡之后���,在組織中停留時(shí)間越短���,越有利減少副作用,因此����,在安全性和用藥便利性方面,半衰期短成為APG-2575相較Venetoclax的一項(xiàng)優(yōu)勢(shì)��。APG-2575去年在中國(guó)啟動(dòng)血液腫瘤的I期臨床研究���,成為首個(gè)進(jìn)入臨床階段的國(guó)產(chǎn)Bcl-2選擇性抑制劑�����。
?
此前���,APG-2575針對(duì)治療血液腫瘤的I期臨床試驗(yàn)已在美國(guó)和澳大利亞啟動(dòng)���。公布的臨床結(jié)果顯示,迄今未觀察到任何劑量限制性毒性(DLT)以及Bcl-2抑制劑常見的腫瘤溶解綜合征(TLS)�����,證實(shí)了良好的安全性�。正是基于APG-2575良好的臨床前數(shù)據(jù)及早期臨床數(shù)據(jù),亞盛醫(yī)藥針對(duì)APG-2575在聯(lián)合CD20 單抗�����、BTK抑制劑等藥物治療多個(gè)血液腫瘤適應(yīng)癥的Ib/ II期研究接連獲得中美兩國(guó)藥監(jiān)部門的臨床許可�。
?
Bcl-2/Bcl-xL抑制劑APG-1252目前在中美澳三地推動(dòng)臨床,主要的方向是單藥或聯(lián)合治療小細(xì)胞肺癌(SCLC)和非小細(xì)胞肺癌(NSCLC)����。
?
談到APG-1252以SCLC這一獨(dú)特適應(yīng)癥入手�,楊大俊表示��,選擇性靶向Bcl-2的產(chǎn)品主要用于血液腫瘤����,是因?yàn)閷?shí)體瘤中有Bcl-xL蛋白表達(dá)���,單獨(dú)抑制Bcl-2���,對(duì)實(shí)體瘤沒(méi)什么效果。雙靶點(diǎn)的APG-1252����,可以同時(shí)抑制兩個(gè)靶點(diǎn),臨床前的數(shù)據(jù)也顯示�����,APG-1252單藥對(duì)SCLC比較敏感��;另外�����,SCLC中第三號(hào)家族蛋白MCL-1表達(dá)相對(duì)比較低,不會(huì)對(duì)產(chǎn)品療效有太大影響���;而SCLC也是臨床挑戰(zhàn)非常大���,目前缺乏有效藥物的瘤種。
?
選擇較為獨(dú)特適應(yīng)癥的策略在IAP抑制劑APG-1387的開發(fā)上也有體現(xiàn)��。在實(shí)體瘤之外���,APG-1387還在中國(guó)開展了治療乙肝的臨床�����,目前已經(jīng)完成了Ⅰb期研究�。APG-1387治療乙肝的機(jī)理是可有效抑制肝細(xì)胞中的IAPs表達(dá),促進(jìn)病毒特異性T細(xì)胞介導(dǎo)的HBV DNA和HBV表面抗原的消除,從而達(dá)到功能性治愈慢性乙肝�����。IAP抑制劑用于治療乙肝病毒感染的優(yōu)勢(shì)在于��,依靠特異性T細(xì)胞的識(shí)別能力�����,能優(yōu)先殺死感染細(xì)胞而不影響健康細(xì)胞���。擁有全新的作用機(jī)理��,也讓APG-1387有跟核苷類藥物及RNAi產(chǎn)品聯(lián)合的可能。
?
而MDM2-p53抑制劑APG-115Ⅰb/Ⅱ目前正在中美兩地進(jìn)行兩項(xiàng)單藥治療晚期實(shí)體瘤或淋巴瘤患者的I期臨床試驗(yàn)��。同時(shí)����,APG-115聯(lián)合帕博利珠單抗的Ⅱ期臨床試驗(yàn)也在美國(guó)進(jìn)行中。
?
在覆蓋諸多潛力靶點(diǎn)之外��,產(chǎn)品為中國(guó)唯一或第一也是亞盛在布局細(xì)胞凋亡產(chǎn)品線時(shí)的重要策略����。以APG-115為例,APG-115在2017年7月即獲得CDE批準(zhǔn)開展臨床�����,而羅氏同類產(chǎn)品Idasanutlin在2019年7月臨床申請(qǐng)才獲受理���。
?
抓住聯(lián)合治療機(jī)遇
?
在亞盛細(xì)胞凋亡產(chǎn)品線布局中���,聯(lián)合治療的諸多合作也格外引人注目�����。
?
如去年4月����,亞盛與君實(shí)生物合作探索APG-1387+PD-1單抗特瑞普利聯(lián)合用藥方案��;2018年12月���,與嘉和生物合作探索APG-115+PD-1抑制劑杰諾單抗(GB226)的聯(lián)合方案�����;APG-115與APG-1387也均有聯(lián)合帕博利珠單抗的臨床在進(jìn)行中��。
?
聯(lián)合治療已然是腫瘤藥物開發(fā)領(lǐng)域公認(rèn)的未來(lái)趨勢(shì)����,以細(xì)胞凋亡產(chǎn)品聯(lián)合免疫治療是其中一個(gè)重要方向����,顯然也成為亞盛的發(fā)展策略之一�����。
?
楊大俊從機(jī)理角度進(jìn)行了解釋:誘導(dǎo)凋亡的小分子藥物�����,除了誘導(dǎo)腫瘤細(xì)胞凋亡���,殺傷腫瘤細(xì)胞����,還有一個(gè)很重要的功能是免疫調(diào)節(jié),比如增加T細(xì)胞��、巨噬細(xì)胞的調(diào)整等���。細(xì)胞凋亡藥物與PD-1抑制劑聯(lián)合���,可以把阻礙PD-1抑制劑發(fā)揮作用的抑制因素去除掉,因此是相對(duì)合適的聯(lián)合方案�。
?
事實(shí)上���,不僅僅PD-1單抗鐘意聯(lián)合細(xì)胞凋亡產(chǎn)品,筆者此前采訪中了解到很多BTK抑制劑也以聯(lián)合Bcl-2抑制劑作為發(fā)展重要方向���,這也可能為產(chǎn)品線豐富的亞盛后續(xù)合作帶來(lái)了很多獨(dú)家的優(yōu)勢(shì)和機(jī)會(huì)�。
?
下一代激酶抑制劑逆襲
?
在亞盛進(jìn)入臨床階段的8個(gè)產(chǎn)品中�����,除了5款細(xì)胞凋亡產(chǎn)品�����,還有3款下一代激酶抑制劑���,其中第三代BCR-ABL/KIT抑制劑HQP1351有望成為亞盛首個(gè)實(shí)現(xiàn)商業(yè)化的產(chǎn)品�����。
?
HQP1351主要針對(duì)格列衛(wèi)耐藥的慢性髓性白血?��。–ML)患者,尤其是T315I突變患者(T315I突變是最為常見的耐藥類型之一����,發(fā)病率約20%)����,全球只有一款同類的三代產(chǎn)品普納替尼上市�。
?
HQP1351目前在中國(guó)開展了針對(duì)耐藥CML的Ⅱ期關(guān)鍵注冊(cè)臨床和胃腸道間質(zhì)瘤(GIST)的Ⅰ期臨床,并在2019年7月�,獲FDA批準(zhǔn)直接進(jìn)入Ⅰb期臨床。
?
楊大俊表示��,F(xiàn)DA批準(zhǔn)產(chǎn)品直接進(jìn)入Ⅰb期���,一方面基于產(chǎn)品的數(shù)據(jù)�����,HQP1351在中國(guó)已經(jīng)完成了100多例患者的Ⅰ期臨床,劑量爬坡和擴(kuò)增中設(shè)立3個(gè)劑量組����,每個(gè)劑量組納入20余位患者,Ⅰ期臨床的數(shù)據(jù)比較完整充分���;另一方面是考慮美國(guó)的患者�����,沒(méi)有必要從Ⅰ期開始進(jìn)行最低劑量爬坡�。
?
此前,亞盛連續(xù)兩年(2018�����、2019年)在美國(guó)血液病學(xué)會(huì)(ASH)年會(huì)上公布HQP1351的1期臨床進(jìn)展:針對(duì)一代�、二代TKI耐藥的CML患者,包括處于慢性期(CP)和加速期(AP)的不同患者����。CP患者完全血液學(xué)緩解(CHR)率為95%,主要細(xì)胞遺傳學(xué)緩解(MCyR)率為69%����,37%達(dá)到主要分子學(xué)反應(yīng)(MMR);攜有T315I的CP患者����, MCyR率高達(dá)82%。AP患者CHR為85%����,MCyR為43%��。與同類普納替尼相比�����,效果具有可比性�����,安全性更好�。
?
這也助推HQP1351很快成為亞盛的核心產(chǎn)品之一�。
?
2018年12月,亞盛與CDE溝通HQP1351的Ⅱ期臨床方案���,并獲準(zhǔn)在完成Ⅱ期試驗(yàn)后即可提交新藥上市申請(qǐng)(NDA)�����。據(jù)了解��,這項(xiàng)關(guān)鍵注冊(cè)Ⅱ期已在9月完成60例患者入組,計(jì)劃2020年6月左右遞交NDA申請(qǐng)��,有望2021年正式獲批上市�。
?
2020臨床進(jìn)度條
?
對(duì)于亞盛而言��,多個(gè)產(chǎn)品處于臨床階段���,并且均看到一定積極的療效和安全性信號(hào),顯然推動(dòng)臨床進(jìn)展是其現(xiàn)階段首要任務(wù)��。
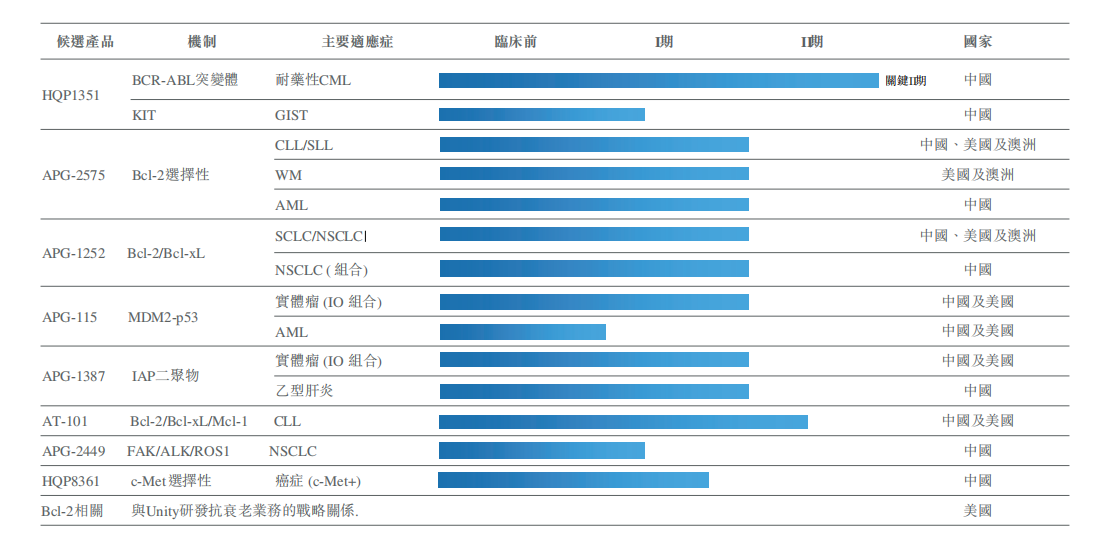
在3月30日的2019業(yè)績(jī)發(fā)布電話會(huì)上��,楊大俊即表示�����,亞盛在這一年中希望達(dá)成以下幾個(gè)重要的臨床節(jié)點(diǎn):第一���,遞交HQP1351的NDA申請(qǐng)���;
?
第二,APG-2575近期已獲得FDA兩項(xiàng)IND許可��,分別為單藥或聯(lián)合治療復(fù)發(fā)/難治慢性淋巴細(xì)胞白血病/小淋巴細(xì)胞淋巴瘤(CLL/SLL)和華氏巨球蛋白血癥(WM)的全球Ib/II期臨床研究�����,其中,治療CLL/SLL的臨床研究已完成美國(guó)首例患者給藥���。同時(shí)獲得CDE一項(xiàng)IND許可����,單藥或聯(lián)合治療復(fù)發(fā)/難治性急性髓系白血?。ˋML)的Ib期研究(編者注:截至發(fā)稿,亞盛醫(yī)藥APG-2575又獲得CDE一項(xiàng)新的IND許可�����,單藥或聯(lián)合治療復(fù)發(fā)/難治CLL/SLL的Ib/II期臨床研究)��。這三個(gè)適應(yīng)癥均是相應(yīng)靶點(diǎn)領(lǐng)域證實(shí)有效的��,艾伯維同類產(chǎn)品Venetoclax主要的適應(yīng)癥就是這三個(gè)����。公司希望取得進(jìn)一步進(jìn)展。
?
第三���,APG-115��、APG-1387均開展了與帕博利珠單抗即K藥的臨床Ib聯(lián)合研究���,臨床上,兩個(gè)產(chǎn)品在耐藥的復(fù)發(fā)難治性的最晚期癌癥患者中均看到CR或PR的病例���。如APG-115的聯(lián)合研究中�,入組的19例患者中14例可以評(píng)估�����,1例卵巢癌患者達(dá)到CR����,兩例達(dá)到PR,其中包括一位接受多種治療無(wú)效的�����、使用了PD-1抗體復(fù)發(fā)的NSCLC患者�����。公司希望這兩個(gè)產(chǎn)品在后續(xù)擴(kuò)大人群的研究中有進(jìn)一步進(jìn)展����。
?
最后���,APG-1387針對(duì)乙肝適應(yīng)癥已完成Ib期臨床,在一周一次給藥(給藥4周)��,觀察3個(gè)月后���,4個(gè)劑量組中��,接近90%患者DNA水平下降�����,60%以上表面抗原下降��。公司已經(jīng)遞交Ⅱ期臨床申請(qǐng)��。
?
邁向完整制藥企業(yè)
?
2019年10月28日����,亞盛正式登陸港交所�����,并且實(shí)現(xiàn)超購(gòu)達(dá)751倍�。隨后�,亞盛就在蘇州啟動(dòng)全球總部��、研發(fā)中心�����、產(chǎn)業(yè)基地的大手筆工程����。這顯然是其進(jìn)入快速發(fā)展階段的重要標(biāo)志�。
據(jù)了解,公司將按照國(guó)際cGMP標(biāo)準(zhǔn)建立全球生產(chǎn)基地�����,為后續(xù)進(jìn)入全球醫(yī)藥市場(chǎng)提供支持��。而廠房建設(shè)項(xiàng)目一期完成后��,口服固體產(chǎn)能為1.3億片或粒以上��;全部項(xiàng)目建成后�,口服固體產(chǎn)能為5億片或粒以上,凍干粉針2000萬(wàn)瓶以上�。
在商業(yè)化方面����,亞盛未來(lái)的整體布局是從研發(fā)走向生產(chǎn)���、銷售���,長(zhǎng)期會(huì)建立自己的銷售團(tuán)隊(duì),打造完整的制藥企業(yè)���。但短期內(nèi)��,亞盛比較開放��,會(huì)積極需求各類形式的合作�。
楊大俊表示�,公司定位于全球創(chuàng)新與全球市場(chǎng),“中國(guó)創(chuàng)新藥企出海有三個(gè)很重要的核心因素:第一���,要有全球的專利保護(hù)�����,我們的每一個(gè)藥�,都是基于結(jié)構(gòu)的專利,目前在全球已經(jīng)獲得了80項(xiàng)專利授權(quán)�;第二,在開發(fā)過(guò)程中���,尤其臨床開發(fā)的過(guò)程需按照國(guó)際標(biāo)準(zhǔn)���,特別通過(guò)公認(rèn)最難的美國(guó)FDA的認(rèn)可�����,我們?cè)诿绹?guó)已獲得8個(gè)IND�,將進(jìn)一步推進(jìn)全球?qū)用娴呐R床開發(fā);第三就是符合前面兩點(diǎn)后����,還需具備商業(yè)化能力?!?/strong>