
利用慧渡醫(yī)療獨(dú)創(chuàng)的cfDNA無創(chuàng)傷液態(tài)活檢技術(shù)����,該研究對梅奧醫(yī)學(xué)中心收集的250例美國前列腺癌患者血漿進(jìn)行了深入解析,揭示了轉(zhuǎn)移性激素敏感型前列腺癌 (mHSPC) 及轉(zhuǎn)移性去勢抵抗型前列腺癌 (mCRRC) 的基因變異分子圖譜����,包括TP53基因突變、RB1拷貝數(shù)缺失�、AR基因擴(kuò)增�����、BRCA2基因缺失等���。?
該研究表明多種分子標(biāo)志物的基因信號與臨床預(yù)后具有顯著相關(guān)性,提示臨床有必要對于需要全身治療的前列腺癌患者在治療前期進(jìn)行基因檢測�����,指導(dǎo)前列腺癌臨床治療方案���。
?
研究回顧
前列腺癌是近年來普遍關(guān)注的全球性健康問題�����,全球每年報告126萬例�,并導(dǎo)致375,000多例死亡�����,前列腺癌診療進(jìn)入精準(zhǔn)醫(yī)療時代��。雄激素剝奪療法 (ADT) 及阻斷雄激素受體下游通路是轉(zhuǎn)移性前列腺癌最常用的療法��,其治療效果很大程度上依賴于患者攜帶的腫瘤分子遺傳標(biāo)志物特征��。尤其是當(dāng)mHSPC向mCRPC轉(zhuǎn)化時��,其基因變異圖譜的差異往往與患者對治療方案的敏感性及總體的預(yù)后存在高度關(guān)聯(lián)�����。臨床上亟需了解前列腺癌疾病發(fā)生和發(fā)展過程中的基因變異的分子機(jī)制�。
?
應(yīng)用慧渡醫(yī)療的ctDNA液態(tài)活檢技術(shù)平臺,研究者發(fā)現(xiàn)在疾病進(jìn)展過程中�,mHSPC和mCRPC患者血液中來自腫瘤基因變異的ctDNA比例和血液中的腫瘤負(fù)荷TMB (tumor mutation burden) 存在顯著差異。
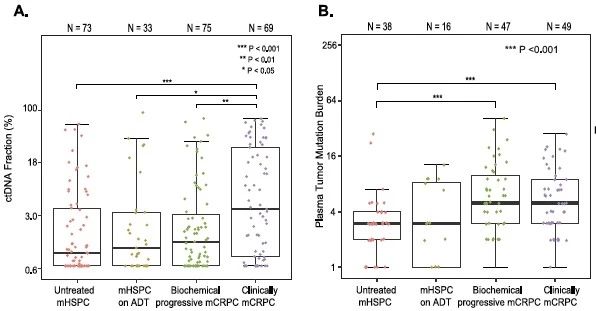
前列腺癌進(jìn)展中的ctDNA比例和TMB變化
進(jìn)一步分析顯示��,綜合評估血液中游離cfDNA含量���、腫瘤ctDNA比例����、以及堿性磷酸酶ALP水平等多項腫瘤生物標(biāo)志物指標(biāo)�����,可以更好的區(qū)分開患者對ADT的敏感性并預(yù)測疾病整體預(yù)后。
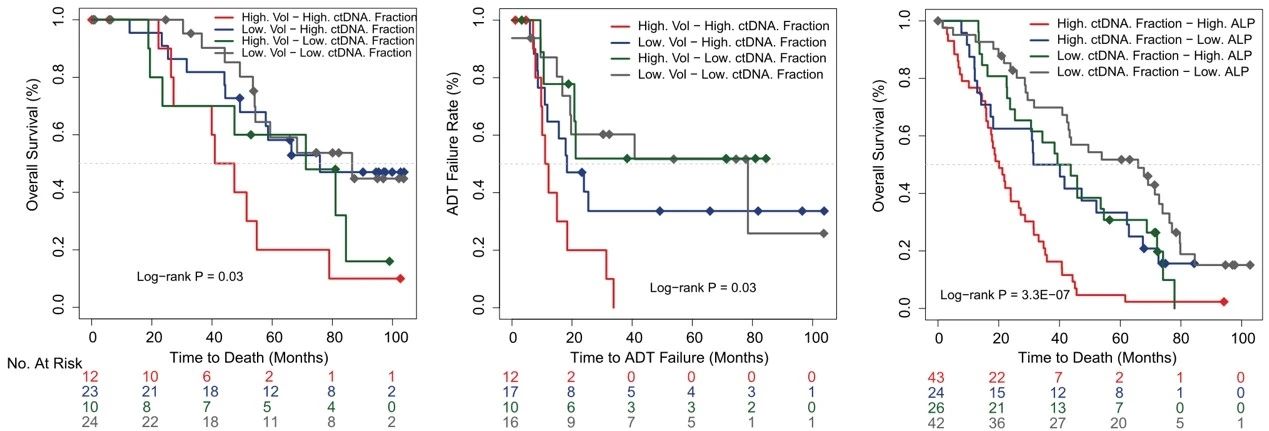
患者預(yù)后/ADT敏感性與cfDNA含量�、腫瘤ctDNA比例及ALP的關(guān)系
?
基因變異圖譜分析顯示,在血液ctDNA中的AR��、APC等基因在mCRPC中的突變頻率顯著高于mHSPC����。此外,在mCRPC中TP53基因突變���、RB1拷貝數(shù)缺失和AR擴(kuò)增與臨床預(yù)后高度相關(guān)����。在mHSPC中����,研究者著重分析了與ADT相關(guān)聯(lián)的特異性分子標(biāo)志物,并發(fā)現(xiàn)多個DNA修復(fù)相關(guān)基因 (ATM, BRCA2, BRCA1, CHEK2) 突變和基因缺失是影響ADT療效的關(guān)鍵因素����。
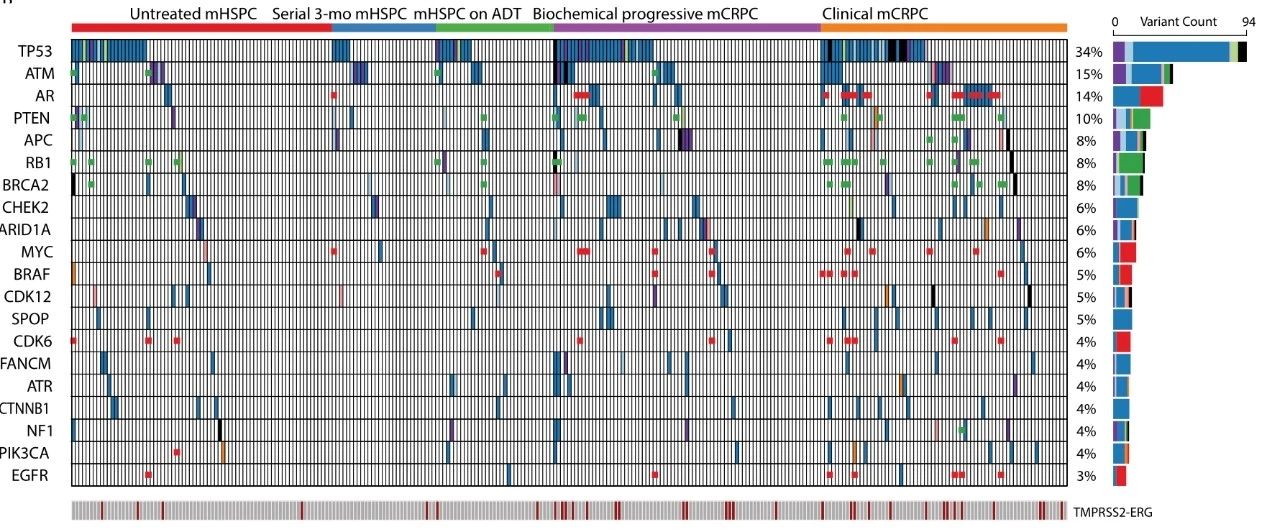
慧渡醫(yī)療ctDNA NGS靶向測序解析mCRPC與mHSPC整體變異圖譜
“液態(tài)活檢技術(shù)的最大挑戰(zhàn)是能否在患者血液中檢測出單鏈或者雙鏈水平的基因缺失?;鄱舍t(yī)療的液態(tài)活檢技術(shù)實現(xiàn)了對BRCA2和PTEN等基因變異(缺失、突變和擴(kuò)增)的同步全面檢測���,也得到藥企和醫(yī)生的高度認(rèn)可和臨床采用�?���!蔽恼峦ㄓ嵶髡?Manish Kohli 博士說?���!氨卷椦芯繉τ陂_發(fā)AR和PARP抑制劑的前列腺癌新藥臨床試驗具有重要應(yīng)用價值?��!?/span>
?
“這項研究的樣本非常寶貴��。我們的合作方美國梅奧醫(yī)學(xué)中心花了10年時間收集前列腺癌臨床樣本����,建立了8年的患者整體生存率隨訪數(shù)據(jù)��?!被鄱舍t(yī)療的創(chuàng)始人兼CEO賈士東博士說?����!霸撗芯拷沂镜那傲邢侔┮簯B(tài)活檢分子機(jī)制,對轉(zhuǎn)移性前列腺癌的臨床治療�����、預(yù)后評估�����、用藥監(jiān)測和新藥臨床試驗具有重要的指導(dǎo)意義��?!?/span>
?
目前,慧渡醫(yī)療與世界各地的頂尖醫(yī)療機(jī)構(gòu)和歐美國際藥企建立了密切的科研和業(yè)務(wù)合作�。通過在中美的國際標(biāo)準(zhǔn)實驗室網(wǎng)絡(luò)體系和一站式生物標(biāo)記物平臺,慧渡醫(yī)療對血液�、尿液和腫瘤組織進(jìn)行基因檢測,實現(xiàn)了靶向用藥指導(dǎo)����、療效動態(tài)監(jiān)控、抗藥性和預(yù)后評估的分子機(jī)制分析�����,為新藥臨床試驗提供生物標(biāo)記物解決方案����。
?
閱讀原文請點(diǎn)擊題目鏈接:
In?EBioMedicine, 2020
Clinical and genomic insights into circulating tumorDNA-based alterations across the spectrum of metastatic hormone-sensitive and castrate-resistantprostate cancer.